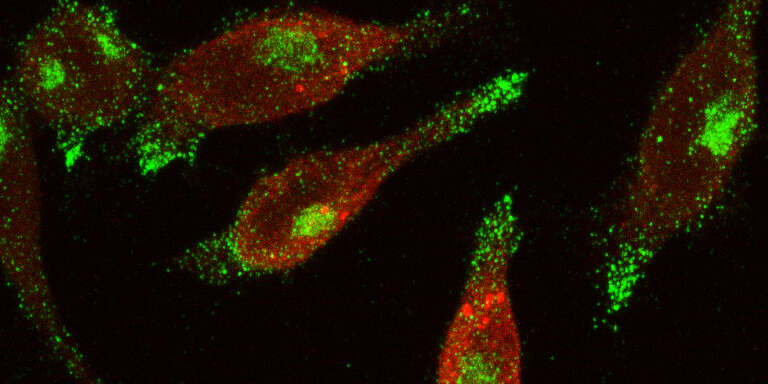
In der Vergangenheit wurden Amyloide hauptsächlich mit neurodegenerativen Erkrankungen in Verbindung gebracht. Diese festen, unlöslichen Proteinverklumpungen schädigen die Nervenzellen. Die Forschungsgruppe von Prof. Martin Spiess am Biozentrum der Universität Basel hat nun beim Hormon Vasopressin entdeckt, dass diese Ablagerungen auch wichtige physiologische Funktionen erfüllen. So ist Vasopressin in der Zelle in Form von amyloid-ähnlicher Granula gespeichert. Dies sind winzige Körnchen, die bei Bedarf ins Blut abgegeben werden, sich auflösen und das Hormon freisetzen.
Der Zelltod – eine Folge von Proteinverklumpungen
Bei neurodegenerativen Erkrankungen sterben Nervenzellen durch Amyloide ab. Auch beim Hormon Vasopressin waren bislang nur die negativen Folgen solcher Proteinverklumpung bekannt: Mutationen im Vasopressin-Gen führen dazu, dass sich das defekte Hormon nicht richtig faltet und im Sekretionsweg zurückgehalten wird. Dabei bilden sich unlösliche Protein-Amyloide, die die produzierenden Nervenzellen im Gehirn zugrunde richten. Patienten mit einem solchen Gen-Defekt leiden an der Krankheit Diabetes insipidus. Da ihnen das Hormon fehlt, scheiden sie täglich statt der normalen ein bis zwei etwa zehn bis zwölf Liter Harn aus. Denn Vasopressin sorgt in der Niere normalerweise dafür, dass Wasser in den Körper zurücktransportiert und konzentrierter Harn ausgeschieden werden kann.
Amyloid-ähnliche Proteinaggregate können funktional wichtig sein
Doch können Proteinablagerungen auch eine wichtige physiologische Funktion übernehmen. Das hat die Forschungsgruppe von Martin Spiess nun bestätigt. Sie konnten im Vasopressin zwei Abschnitte identifizieren, die beim mutierten Protein die Bildung schädlicher Amyloide forcieren. «Interessanterweise sind dieselben Bereiche beim normalen Hormon später im Sekretionsweg für die Entstehung der natürlichen Granula verantwortlich», erklärt Spiess. «Dabei handelt es sich um amyloid-ähnliche Proteinaggregate, die physiologisch wichtig sind.» Das in den Granula verpackte Vasopressin wandert an die Nervenendigungen und wird auf ein Signal hin ins Blut ausgeschüttet. Die Granula dient also dazu, das Hormon in einem Zwischenspeicher zu lagern.
Schädliche Amyloide – eine negative Folge der Granula-Bildung
Mit ihrer Arbeit konnten die Forscher die Hypothese bestätigen, dass die Granula der Hirnanhangsdrüse aus funktionellen Amyloiden besteht und der eine wichtige physiologische Funktion bei der Sekretion von Hormonen zukommt. Schädliche Protein-Aggregate von defekten Proteinen scheinen somit eine negative Auswirkung der Fähigkeit zur Granula-Bildung zu sein. Die Forscher möchten nun klären, was genau auf struktureller Ebene beim Vasopressin passiert und ob Proteinaggregate ein generelles Prinzip für die Bildung von Granula darstellen.
Originalartikel:
Nicole Beuret, Franziska Hasler, Cristina Prescianotto-Baschong, Julia Birk, Jonas Rutishauser, and Martin Spiess. Amyloid-like aggregations of provasopressin in diabetes insipidus and secretory granule sorting. BMC Biology; published online 26 January 2017
Kontakt: Kommunikation, Katrin Bühler