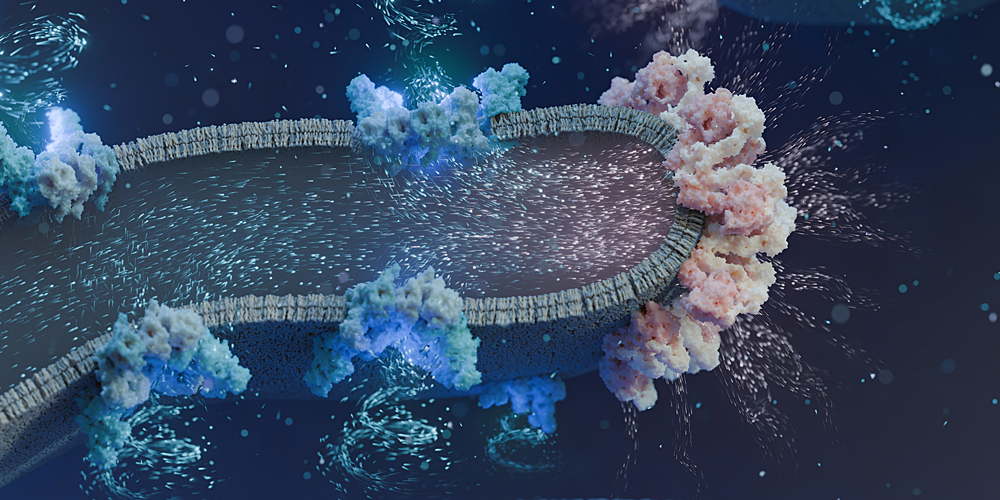
Die meisten Lebewesen auf unserem Planeten – seien es Pflanzen, Tiere oder Menschen – besitzen Mitochondrien in ihren Zellen. Diese stellen die Energie für nahezu alle zellulären Prozesse bereit. Dazu nutzen sie den Sauerstoff, den wir einatmen, und Kohlenhydrate aus der Nahrung um ATP, den universellen Energieträger der Zellen, herzustellen. Genaugenommen übernehmen Proteine diese Aufgabe, die in der sogenannten Atmungskette zusammenarbeiten.
Obwohl die Atmungskette bereits vor 70 Jahren entdeckt wurde, war ihre genaue Organisation innerhalb der Mitochondrien bisher unklar. Mithilfe modernster Kryo-Elektronentomografie gelang es Forschenden um Dr. Florent Waltz und Prof. Ben Engel am Biozentrum der Universität Basel nun, hochauflösende Bilder der Atmungskette direkt in Zellen in einer bisher unerreichten Auflösung aufzunehmen. Die Ergebnisse der Studie wurden in «Science» veröffentlicht.
Neue Einblicke in die Kraftwerke der Zelle
«Unsere Daten zeigen, dass sich die Proteine der Atmungskette in bestimmten Membranregionen der Mitochondrien organisieren, zusammenhaften und Superkomplexe bilden», erklärt Florent Waltz, SNF Ambizione Fellow und Erstautor der Studie. «Im Elektronenmikroskop waren einzelne dieser Superkomplexe deutlich sichtbar – wir konnten ihre Strukturen direkt erkennen und ihre Funktionsweise aufklären. Diese Superkomplexe pumpen Protonen durch die Mitochondrienmembran. Die ATP produzierenden Proteine, die ähnlich wie eine Wassermühle arbeiten, nutzen schliesslich diesen Protonenfluss zur ATP-Herstellung.»
Architektur sorgt für effiziente Energieproduktion
Die Forschenden untersuchten Mitochondrien in lebenden Zellen der Alge Chlamydomonas reinhardtii. «Wir waren sehr überrascht, dass alle Proteine tatsächlich in solchen Superkomplexen organisiert sind», sagt Waltz. «Diese Architektur könnte die ATP-Produktion effizienter machen, den Elektronenfluss optimieren und den Energieverlust minimieren.»
Neben den Superkomplexen konnten die Forscher auch die Membranarchitektur der Mitochondrien genauer untersuchen. «Sie erinnert ein wenig an Lungengewebe: Die inneren Mitochondrienmembranen sind stark gefaltet, wodurch die Oberfläche vergrössert wird, um möglichst viele Proteine der Atmungskette aufzunehmen», sagt Engel.
Neue Perspektiven für Evolution und Gesundheit
Zukünftig wollen die Forscher herausfinden, warum die Superkomplexe in der Atmungskette miteinander verbunden sind und wie diese Synergie die Effizienz der Zellatmung und der Energieproduktion steigert. Die Studie könnte auch neue Erkenntnisse für Biotechnologie und Erkrankungen liefern. «Indem wir die Architektur dieser Superkomplexe in anderen Organismen untersuchen, können wir ein umfassenderes Verständnis ihrer grundlegenden Organisation gewinnen», erklärt Waltz. «Dies könnte nicht nur evolutionäre Anpassungen aufdecken, sondern auch helfen zu verstehen, inwiefern Störungen dieser Architektur bei bestimmten Krankheiten im Menschen eine Rolle spielen.»
Originalbeitrag
Florent Waltz, Ricardo D. Righetto, Ron Kelley, Xianjun Zhang, Martin Obr, Sagar Khavnekar, Abhay Kotecha, Benjamin D. Engel. In-cell architecture of the mitochondrial respiratory chain. Science, March 21, 2025
Kontakt: Kommunikation, Heike Sacher