Cholesterinsenker, Mittel gegen Bluthochdruck oder Malaria, Krebsmedikamente und Antibiotika – viele unserer heutigen Medikamente basieren auf Naturstoffen. Bakterien und Pilzen bilden diese chemischen Stoffe eigentlich, um Konkurrenten zu schädigen oder das Zusammenleben mit Partnern in friedlicher Symbiose zu koordinieren. Die Fähigkeiten der Mikroben werden gezielt für die biotechnologische Herstellung von Arzneistoffen eingesetzt und inspirieren oft auch die chemische Wirkstoffherstellung.
Bauplan legt Produkt fest
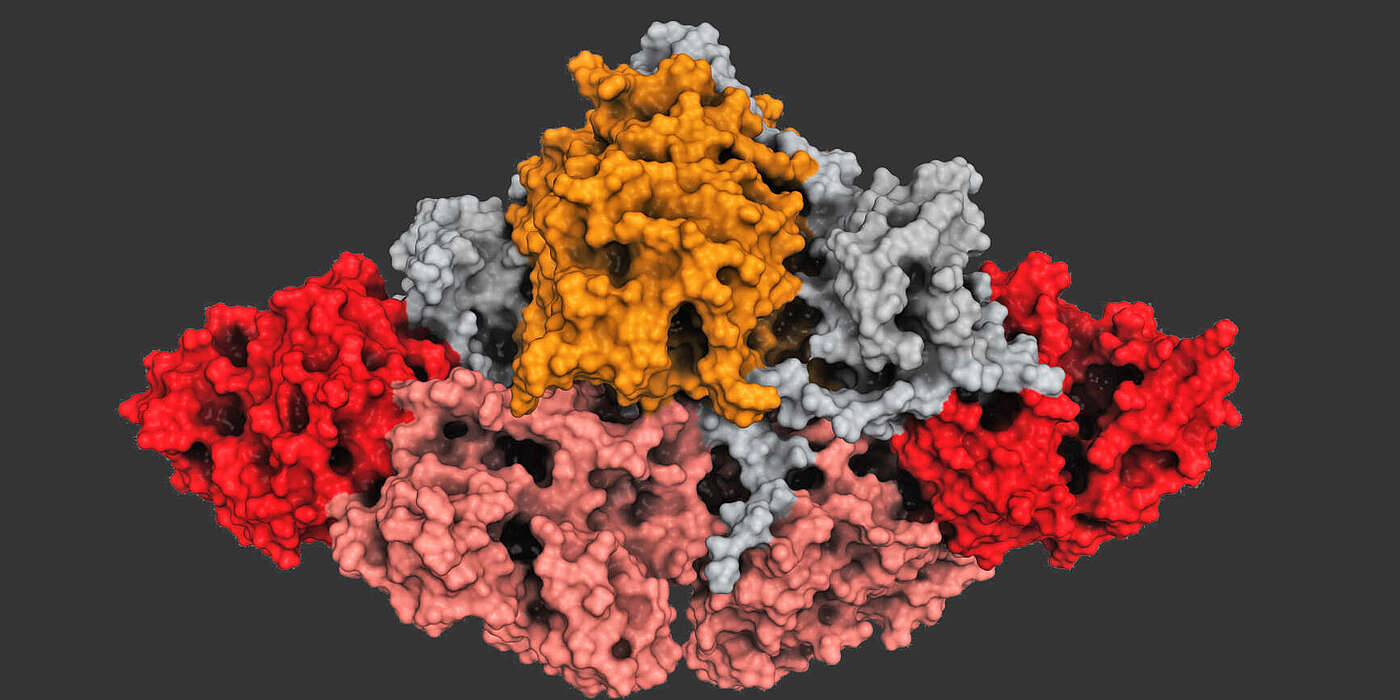
In den Mikroorganismen produzieren molekulare Fabriken, sogenannte Polyketid-Synthasen, ein breites Spektrum an Wirkstoffen, die Polyketide. Diese Fabriken verknüpfen in vielen Einzelschritten, wie an einem Fliessband, einzelne chemischen Bauteile zu langen Ketten. Der Aufbau der Polyketid-Fabriken aus unterschiedlichen Fertigungsstationen bestimmt dabei, welches Produkt am Ende entsteht. Die Gruppe von Prof. Timm Maier am Biozentrum der Universität Basel hat nun gemeinsam mit Partnern von der Johns Hopkins Universität in Baltimore aufgeklärt, wie eine Ladestation am Anfang eines solchen Fliessbandes in die molekulare Fabrik eingebettet ist.
Fabrikaufbau koordiniert Arbeitsschritte
Die untersuchte Polyketid-Synthase besteht aus zwei identischen Proteinsträngen, die jeweils fünf enzymatische Einheiten und ein Trägerprotein enthalten. Die Produktion beginnt damit, dass zunächst ein kurzes Start-Molekül von der Ladestation auf das Trägerprotein geladen wird. Anschliessend hängen die anderen Enzym-Einheiten schrittweise neue Bauteile an das Start-Molekül und verlängern die Kette kontinuierlich bis das Produkt fertig gestellt ist. Anhand der Kristallstruktur lässt sich erkennen, dass die Ladestation – entgegen früherer Ansicht – fest mit der Fabrik verbunden ist.
Durch eine chemische Falle gelang es den Forschern zudem den Zustand der Fabrik im Moment des Beladens einzufangen und strukturell zu untersuchen. So konnten sie zeigen, dass die Arbeit der zwei Stränge miteinander gekoppelt ist. «Das Beladen eines Stranges beeinflusst die Struktur des anderen», so Dominik Herbst, Erstautor der Publikation. «Dadurch können die unterschiedlichen Produktionsschritte in der Fabrik koordiniert ablaufen.»
Mit veränderten Fabriken neue Arzneistoffe herstellen
Derzeit ist es immer noch äusserst aufwändig, neue Wirkstoffe auf der Basis von Polyketiden herzustellen. Die Wissenschaftler um Maier liefern mit ihrer Studie wichtige Hinweise für die Synthese von verbesserten oder sogar neuartigen Arzneimitteln. «Wenn wir verstanden haben, wie die einzelnen Stationen der Polyketid-Fliessbänder zusammenarbeiten, dann können wir sie neu zusammensetzen und umfunktionieren», sagt Maier. Auf diese Weise könne man verbesserte oder bisher unbekannte Arzneistoffe produzieren.
Originalartikel:
Dominik A. Herbst, Callie R. Huitt-Roehl, Roman P. Jakob, Jacob M. Kravetz, Philip A. Storm, Jamie R. Alley, Craig A. Townsend and Timm Maier. The structural organization of substrate loading in iterative polyketide synthases. Nature Chemical Biology, published online 2 April 2018
Contact: Communications, Katrin Bühler