Main Content
NMR-Spektroskopie zur Aufklärung biomolekularer Mechanismen
Wir verwenden die Kernspinresonanz-Spektroskopie (NMR), um Strukturen und Funktionen von Proteinen und ihrer Wechselwirkungen auf atomarer Ebene aufzuklären und so die zugrundeliegenden molekularen Mechanismen zu entschlüsseln.
Proteine sind für zentrale biologische Funktionen von grosser Bedeutung. Dazu gehören Signalweiterleitung, Katalyse, Synthese und Abbau von Biomolekülen, Stoffwechsel und Membrantransport. Die zugrundeliegenden molekularen Prozesse untersuchen wir mithilfe der NMR-Spektroskopie und weiterer biophysikalischer Techniken.
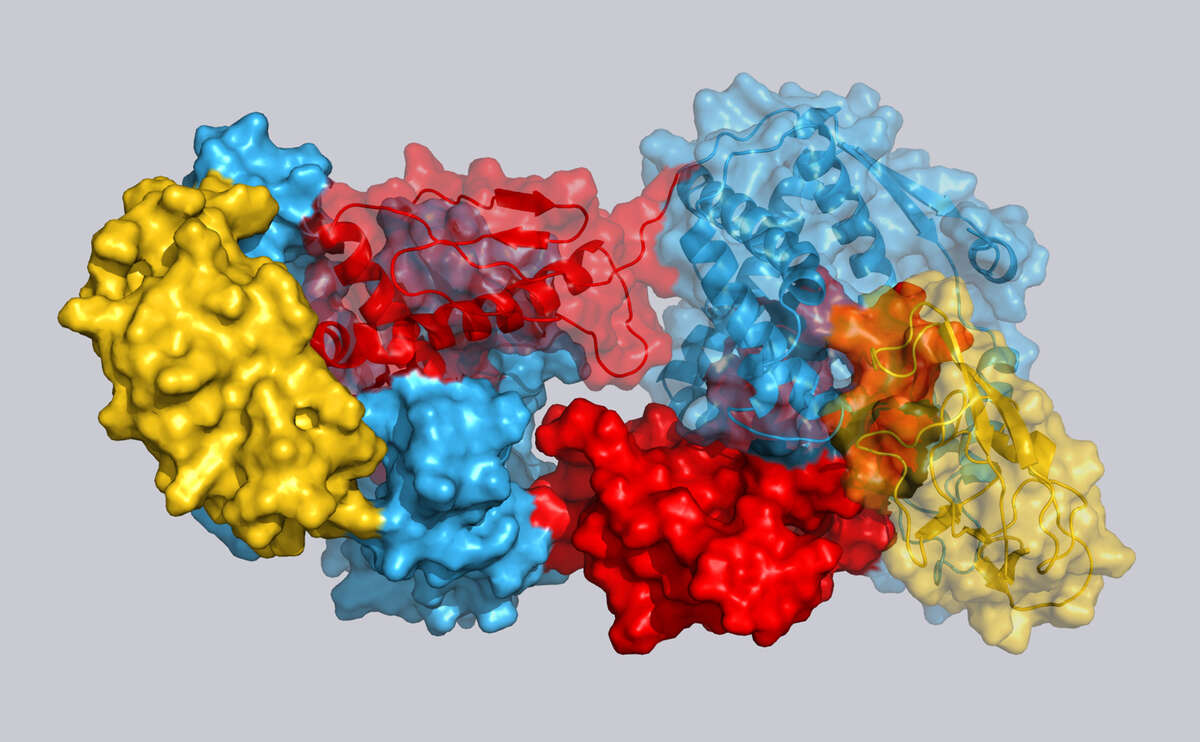
Funktionsweise von Chaperonen
Bestimmte Helferproteine, sogenannte Chaperone, sorgen dafür, dass andere Proteine die richtige Struktur annehmen und transportieren sie an ihren Einsatzort. Wir beschreiben die Struktur und Dynamik grosser Chaperon-Protein-Komplexe auf atomarer Ebene. Dadurch verstehen wir die biophysikalischen Gesetzmässigkeiten, wie Chaperone funktionieren, sowie deren Bedeutung in neurodegenerativen Erkrankungen, wie Parkinson.
Biogenese von äusseren Membranproteinen und neue Antibiotika
Proteine in der äusseren Membran von Bakterien werden durch einer Kette von Chaperonen hergestellt. Wir untersuchen die zugrundeliegenden Interaktionen, Mechanismen und Faltungsreaktionen auf atomarer Ebene. Dabei interessiert uns besonders der Bam-Proteinkomplex, der die Membranproteine faltet und einbaut. Bam ist ein wichtiger Angriffspunkt für die neuen Antibiotika OMPTA und Darobactin.
Dynamische Kinasen und ihre Interaktionen
Kinasen regulieren zentrale zelluläre Funktionen, wie die Signalübermittlung und den Metabolismus. Wir untersuchen, wie in Bakterien Kinasen von bestimmten Botenstoffen kontrolliert werden, und wie der mTOR-Proteinkomplex bei Säugetieren mit verschiedenen Proteinen interagiert und so das Zellwachstum und die Vermehrung kontrolliert. Die Lösungs-NMR ist die optimale Methode für solche Interaktionsstudien zwischen flexiblen Substraten und grossen Kinasemolekülen.



![[Translate to Deutsch:] Model of chaperone droplet formation.](/fileadmin/_processed_/3/c/csm_News_Hiller_NatureCellBiolog_2025_4871e2e6a9.jpg)
